Glycosciences : vers des biocapteurs pour identifier les groupes sanguins

En direct des labos de l’Institut de chimie, le CERMAV à l’honneur : Les surfaces de nos cellules sont recouvertes d’une couche composée de sucres, clé des interactions avec de nombreuses protéines. Lors d’une infection par une bactérie, cette dernière vient ainsi se lier aux sucres sur nos cellules, via un récepteur protéique bactérien. Des chercheurs du Centre de recherches sur les macromolécules végétales (CNRS) et du Centre de biotechnologie industrielle autrichien (ACIB, Graz) ont réussi à modifier la façon dont un tel récepteur interagit avec les groupes sanguins humains.
Scientific Reports
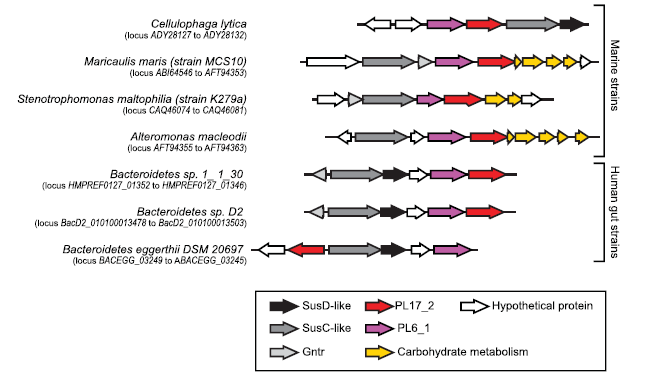
Les bactéries de notre microbiote possèdent un large éventail de gènes impliqués dans la dégradation des polysaccharides de notre alimentation. Il avait déjà été montré que le microbiome intestinal des Japonais contient des gènes impliqués dans la dégradation du porphyran, un polysaccharide extrait des algues rouges Porphyra sp. utilisées pour la préparation des sushi-makis. Ces gènes de dégradation proviendraient d’un transfert de gènes de bactéries marines présentes à la surface des algues. Dans cette étude en collaboration entre le CERMAV et des collègues de Marseille et Trondheim, l’analyse bioinformatique et les expériences biochimiques ont démontré l’existence dans le microbiote humain, de gènes codants pour d’autres enzymes de dégradation des algues. Nous avons démontré que le microbiote des populations asiatiques est capable de dégrader les alginates, des polysaccharides extraits des algues brunes. Nos analyses ont révélé que le transfert de ces gènes des bactéries marines vers le microbiote est un phénomène rare et semble très ancien. Nous avons proposé que l’alimentation joue un rôle de pression de sélection qui a permis la conservation des gènes de dégradation des algues dans les populations asiatiques.
