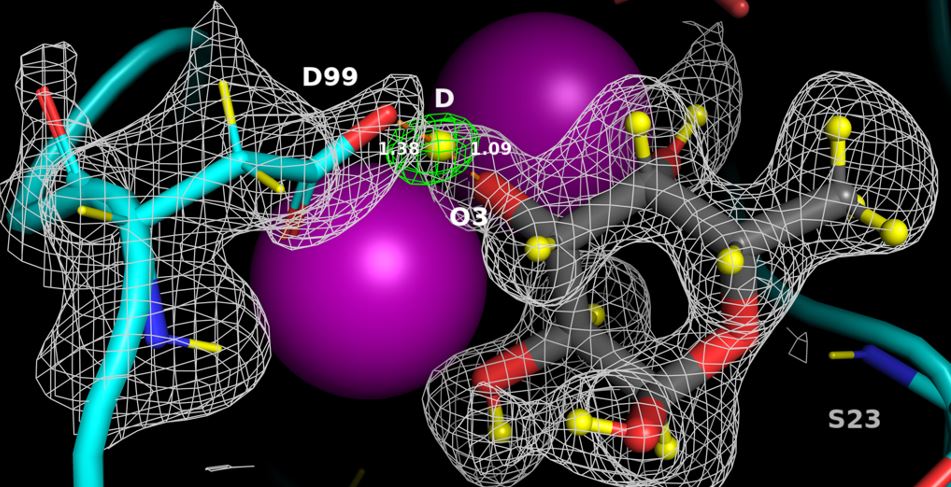
Pseudomonas aeruginosa , bactérie impliquée dans les infections nosocomiales, a été identifiée par l’Organisation mondiale de la santé comme une priorité absolue pour la recherche de nouveaux antibiotiques. Lukas Gajdos, doctorant co-encadré par les équipes du CERMAV et de l’ILL, a utilisé la diffraction des neutrons pour décrypter les mécanismes impliqués dans l’adhésion de cet agent pathogène aux cellules hôtes. La perdeutération de la lectine bactérienne LecB et de son ligand fucose, et la résolution de la structure aux neutrons du complexe ont permis d’identifier les positions de tous les atomes d’hydrogène. La forte affinité de la lectine pour les cellules humaines dépends de la présence d’une liaison hydrogène de faible barrière induite par la proximité des deux ions calcium, de liaisons coordonnées entre le sucre, le calcium et LecB, et du comportement dynamique des molécules d’eau à température ambiante. Ces détails structurels cruciaux peuvent aider à la conception de composés anti-adhésifs pour combattre les infections bactériennes multirésistantes.
L’article est disponible ici.