En parallèle de leur diversité, il existe une pléiade de protéines avec lesquels ils interagissent telles les enzymes de synthèse (glycosyltransférases), de modification ou de dégradation (glycoside hydrolases, polysaccharides lyases, sulfatases, etc…) ou encore les protéines de reconnaissance (lectines). Les sucres jouent un rôle essentiel dans de nombreux processus cellulaires : structure, source d’énergie, immunité ou signalisation moléculaire mais aussi dans de nombreuses pathologies (infections microbiennes ou cancers). Comprendre les interactions mises en jeu dans les mécanismes catalytiques ou de reconnaissance ainsi que les propriétés des glucides ou la fonction des protéines est très important au niveau fondamental comme appliqué en vue d’applications biomédicales ou biotechnologiques.
L’équipe GlycoBiologie Moléculaire et Structurale (GBMS) cherche à disséquer à l’échelle atomique les interactions des glucides avec les protéines impliquées dans leur synthèse, dégradation ou reconnaissance. Sa recherche est à l’interface Chimie-Biologie avec une expertise pluridisciplinaire en bioinformatique, biologie moléculaire, biochimie et enzymologie, cristallographie des protéines au rayons X, analyse des interactions protéines-carbohydrates et modélisation moléculaire.
Les axes de recherche principaux de l’équipe sont:
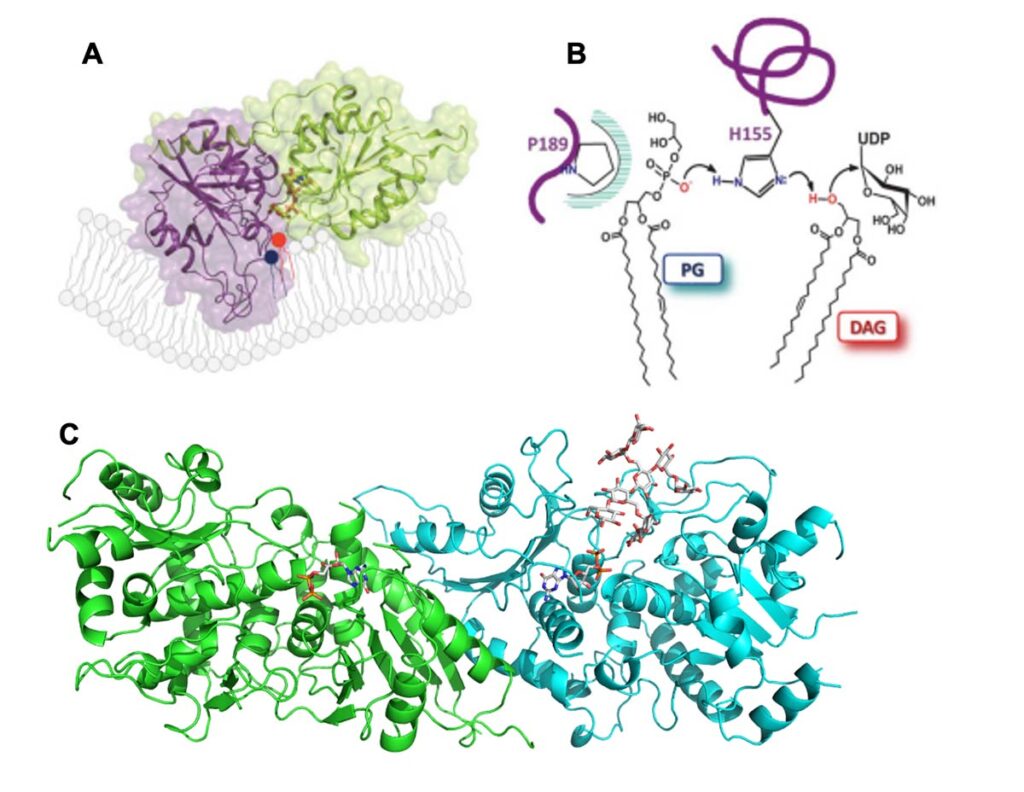
La biosynthèse des glucides complexes par les glycosyltransférases (GTs): C. Breton
La glycosylation est la réaction biochimique la plus importante sur Terre et les GTs sont les enzymes clé de ce processus. Il est donc important de progresser dans la connaissance de leur mécanisme d’action et de leur régulation. Nous concentrons nos efforts sur l’étude des GTs impliquées dans la biogenèse des galactolipides, composés essentiels des membranes photosynthétiques et de la paroi cellulaire végétale avec comme modèle d’étude la synthèse du xyloglucane.
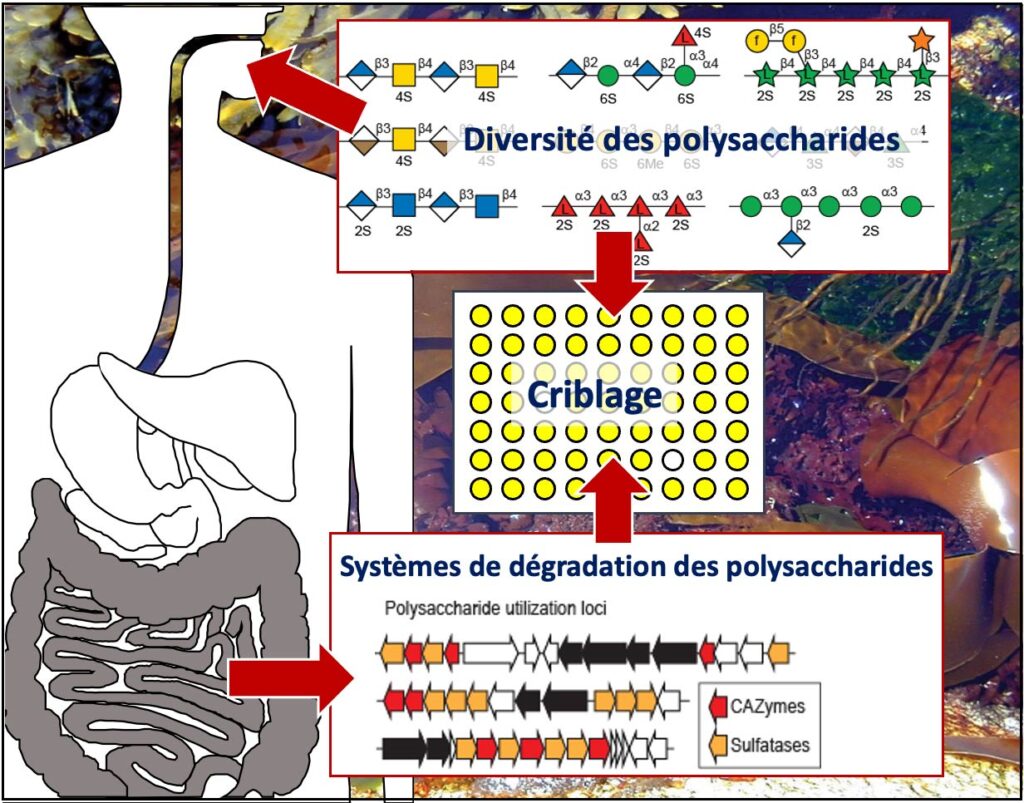
La dégradation des polysaccharides par les PULs : W. Helbert, S. Drouillard & M. Couturier
Par l’étude des Polysaccharides utilization loci (PULs), nous participons à l’effort mondial d’attribution de la fonction des gènes codant pour les enzymes putatives de dégradation des polysaccharides complexes et à la compréhension de leur dégradation. Nous nous concentrons sur les PULs identifiés dans les génomes bactériens et fongiques du microbiote intestinal humain potentiellement impliqués dans la dégradation des polysaccharides végétaux et des polysaccharides sulfatés d’origine marine. Les nouvelles enzymes découvertes peuvent être de nouveaux outils pour la caractérisation structurale des polysaccharides ou pour produire des oligosaccharides comme composés bioactifs potentiels. Les études du mode d’action et de la spécificité des enzymes les plus originales sont conduites à l’aide d’approches enzymologiques modernes (chromatographie, RMN et spectrométrie de masse). Nous maintenons et enrichissons ainsi une collection unique d’environ 200 substrats oligo- et polysaccharides dont la structure des plus originaux est analysée en détail à l’aide du service PCAN (CERMAV) et de la plateforme RMN (ICMG).
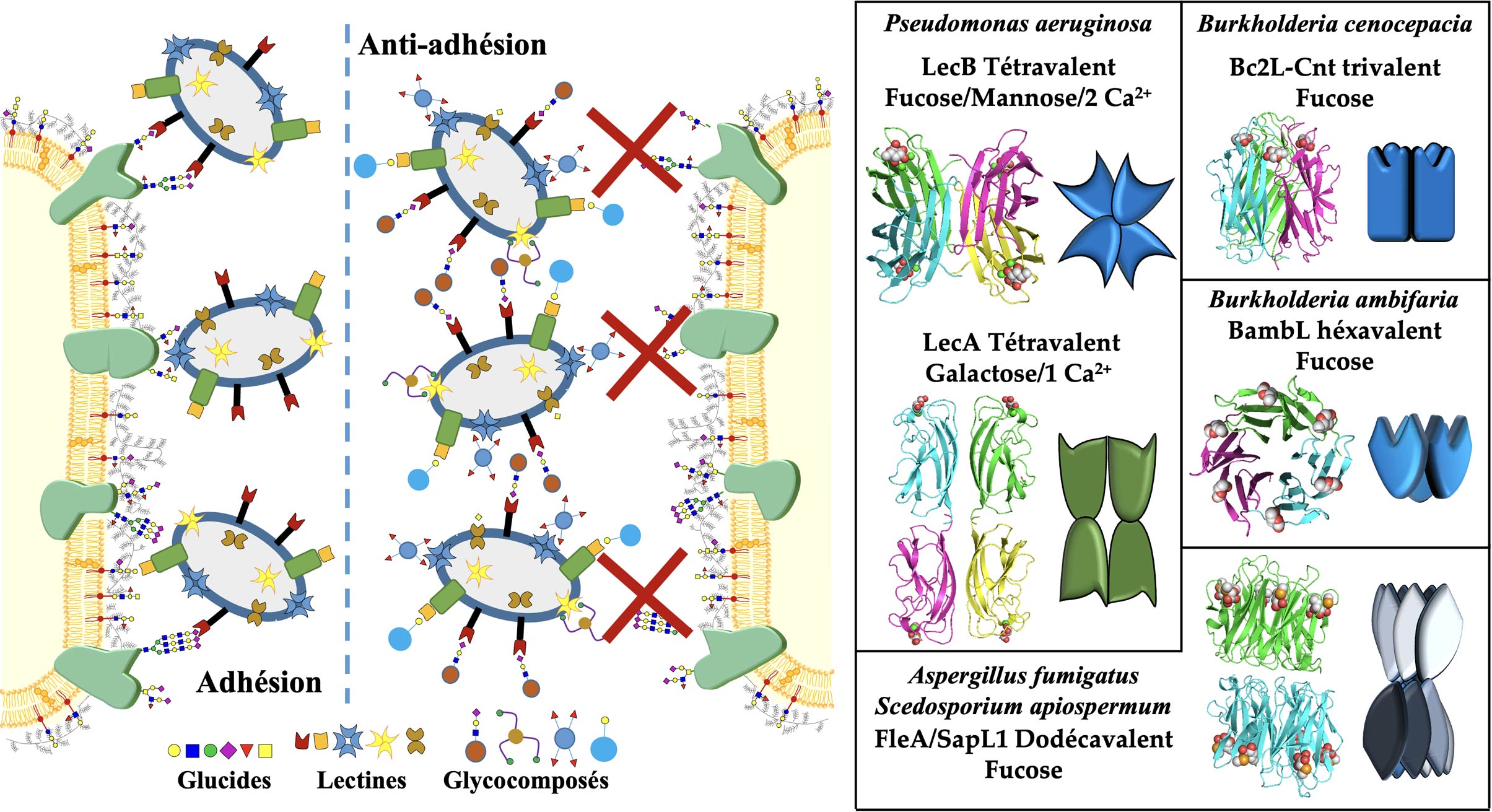
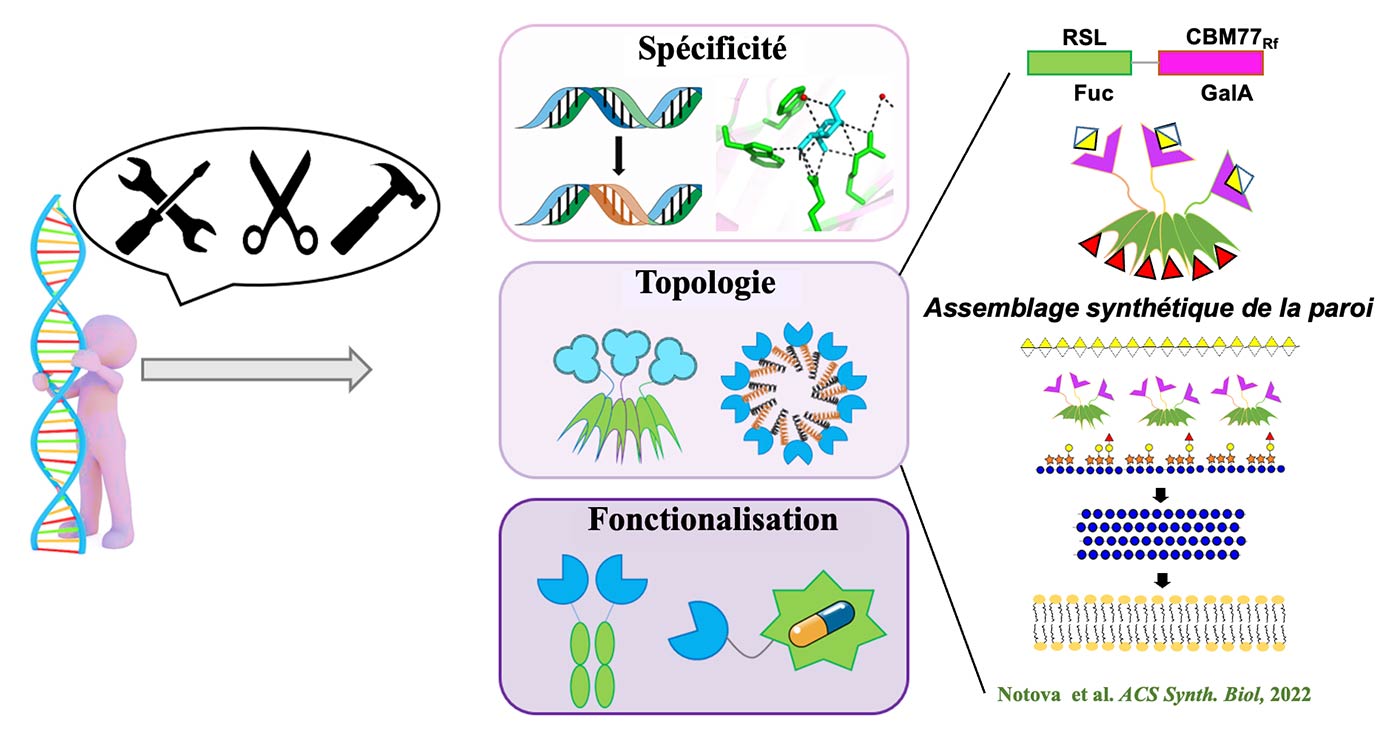
La reconnaissance des glycoconjugués par les lectines : A. Imberty & A. Varrot
Les lectines sont des récepteurs protéiques capables déchiffrer le glycocode. Elles jouent un rôle essentiel dans les interactions hôtes-pathogènes, soit en tant que molécule de défense de première ligne contre les organismes étrangers, soit en favorisant l’adhésion microbienne, étape cruciale dans l’initiation des infections. Les lectines sont aujourd’hui des cibles pour le développement de glycocomposés antiadhésifs qui pourraient être utilisés comme anti-infectieux. Par leur reconnaissance de motifs glucidiques spécifiques, elles sont aussi des outils moléculaires recherchés pour aider au diagnostic et au pronostic de cancers souvent associés à des aberrations de glycosylation et pour le contrôle de la glycosylation des produits biothérapeutiques. Nous nous intéressons aussi à l’identification de nouvelles lectines à la fois au niveau de leur repliement ou de leur spécificité, à l’obtention des bases atomiques régissant les interactions carbohydrates-protéines et dans l’ingénierie des lectines par biologie de synthèse pour modifier leur spécificité ou leur multivalence et créer de nouveaux outils. Nous avons une soixantaine de lectines ou domaine lectine d’origine diverse caractérisés et disponibles sous forme recombinante et 110 structures déposées dans la PDB.
L’équipe GBMS s’implique à mieux faire connaitre les glycosciences. Elle développe des outils et des bases de données: Glyco3D et Unilectin et participe à la diffusion des connaissances dans Glycopedia. Elle développe de nouvelles approches graphiques pour visualiser (SweetUnityMol), étudier mais aussi enseigner les glycosciences.
L’équipe GBMS est partenaire du CDP Glyco@Alps2 dans le cadre de l’IDEX Université Grenoble Alpes (UGA), du Labex Arcane et de l’ITN « GlycoNoVi » financé par l’action HORIZON-MSCA-DN-2021. Elle participe à plusieurs actions Cost : CM1102, CA18132 et CA1803. Elle est actuellement soutenue par l’Agence Nationale pour la Recherche au travers des projets : LectArray, SweetDisplay, S-Plore, CAZyMYC et WITT, par l’association Vaincre la Mucoviscidose, l’UGA et le CNRS.
Composition de l'équipe (Janvier 2025)
Personnel permanent
- Christelle Breton, Prof. – UGA
- Valérie Chazalet, Assistante Ingénieure – CNRS
- Marie Couturier, Chargée de Recherches – CNRS
- Sophie Drouillard, MCF – UGA
- Emilie Gillon, Assistante Ingénieure – CNRS
- William Helbert, Directeur de Recherches – CNRS
- Anne Imberty, Directrice de Recherches – CNRS
- Serge Pérez, Directeur de Recherches émérite – CNRS
- Mélanie Touvrey-Loiodice, CNRS
- Annabelle Varrot, Directrice de Recherches – CNRS (responsable d’équipe)
Personnel non permanent
- Théodore Arnaud, Doctorant
- Flavien Dedieu, Ingénieur de Recherches
- Palig Karaminassian, Doctorante
- Batoul Moubarak, Doctorant
- Manon Quillerrou Moreau, Doctorante
- Luca Pisapla, Doctorant